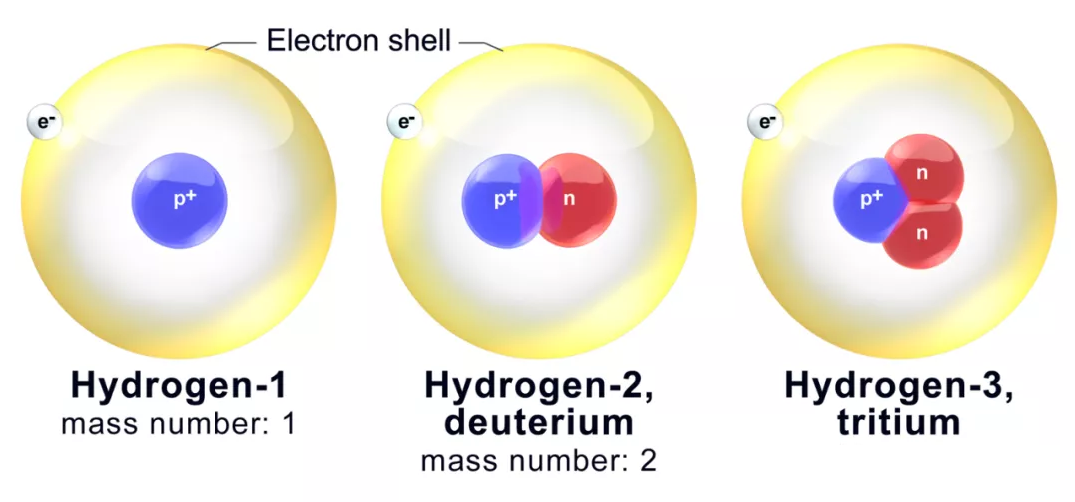
一、氘和氢的区别
氘的摩尔体积较小:0.140cm3/mol per atom
亲油性更弱:Δlog Poct=−0.006
C-D键长更短,比C-H键短了约0.005A,由于D的质量是H的两倍,C-D的振动频率会更低,基态能量也更低,断裂需要的活化能较高,导致反应速率kH> kD
具有不同的Pka值
二、氘代药物历史
1:最早的氘代药物出现在20世纪60年代,完成了酪胺和吗啡的氘代。
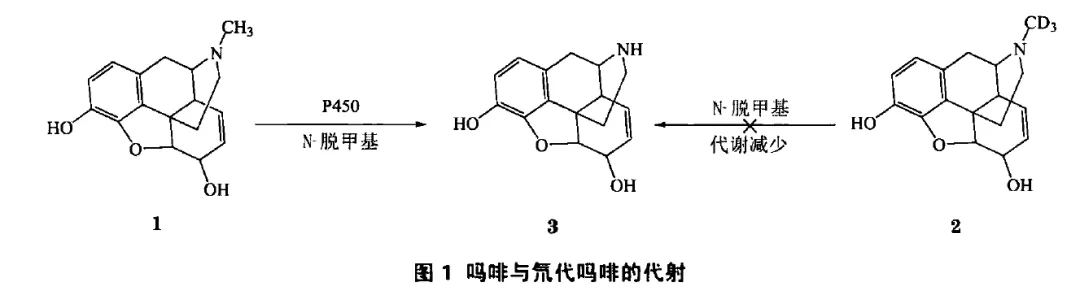
吗啡氘代后可以显著减少生物活性,原因是N-甲基氘代后,减少了N-去甲基代谢物3的形成。
2:此后氘代技术快速发展,氘代药物主要用于内标使用。
药物进行氘标记一方面可以方便地对生物体内的代谢产物进行定位分析,还有助于发现新的代谢产物以便开展代谢机理的研究等。
3:2017年4月,Deutetrabenazine被FDA批准用于治疗与亨廷顿病相关的运动障碍,氘代丁苯那嗪与母药Tetbenazine的适应症相同。
该氘代药物作为新分子实体申报,享有排他性优势,因此提振了氘代药物研发的信心。

4:上面的两个氘代药物属于在母体药物上氘取代氢,还有一些药物在早期阶段就已经引入氘代,比如药物2和3.
5:药物4由于母体药物药代动力学数据较差,几乎废弃,幸而氘代后PK改善,顺利进行I期临床。
三、氘与药物代谢
氘掺入最直接的作用是减缓药物新陈代谢,特别是细胞色素P450(CYP450)介导的转化,氘掺入也会对其他酶催化的氧化转化产生影响。

d3-L-DOPA的开发,清楚地表明,单胺氧化酶(MAO)和多巴胺β-羟化酶(DBH)催化的反应也会受到影响。羧基α和β位的氘代,最终减少了7和8的产生量。
氘代最主要的影响方面:
1:优化药代动力学
很大一部分的氘代药物都是基于此目的。
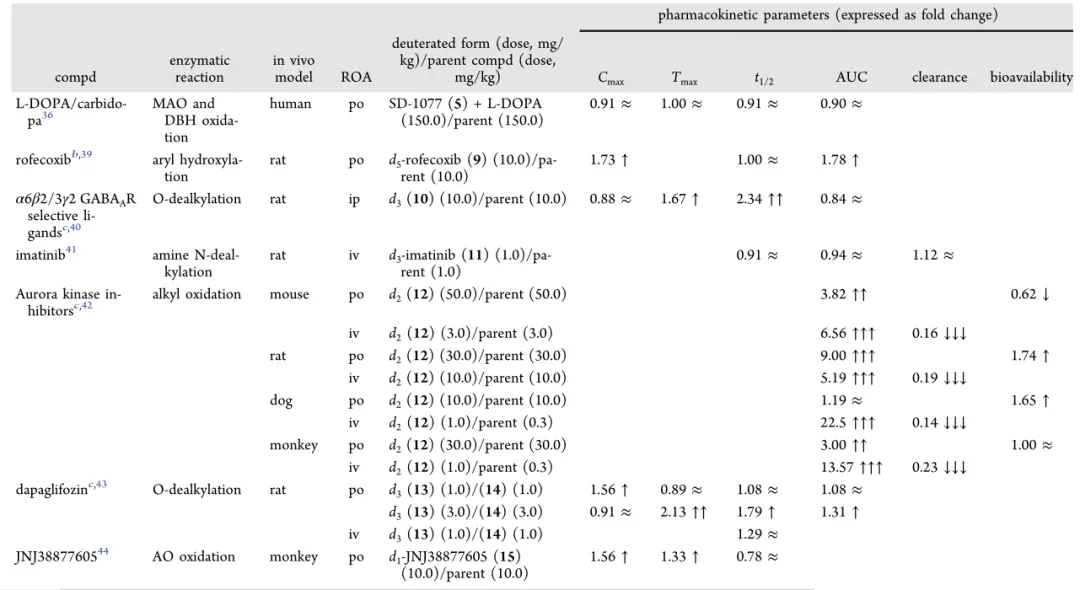
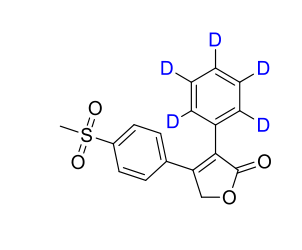
大鼠口服剂量10mg/kg后,氘代罗非考昔血液Cmax为4181μg/L,非氘代Cmax为2416μg/L,半衰期基本一致。
氘还可用于延长药物释放和聚合物的生物降解。
D取代H后,显著延长药物释放和体内消除。
2:减少药物毒性
有些药物代谢后产生具有亲电反应活性的代谢物,这些代谢物可与蛋白质或核酸分子中的亲核基团结合而破坏了它们的正常功能,从而引发致癌、致畸以及免疫介导的毒性。
使用氘代可以减少不需要的代谢物,以及增加所需的活性代谢物,这一现象被称为代谢分流(metabolic shunting)。

通过在异环磷酰胺的α碳上替换氘,可以有效增加所需的4'位的羟基化以及减少N-脱卤产物。
3:增加生物活性
氯吡格雷的哌啶全氘代增强了前药在体外的激活率。
55的生物活性为19.3%,非氘代为14.5%。
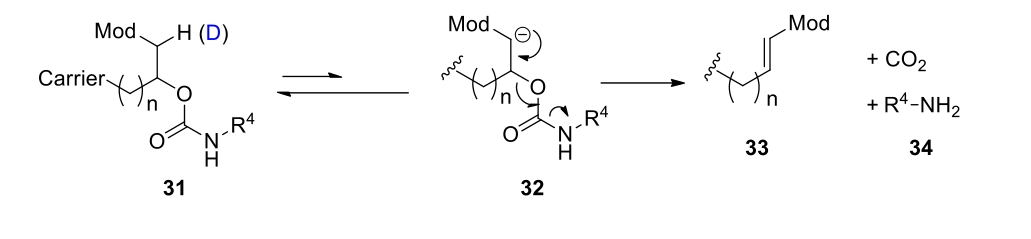
 4:稳定容易消旋的立体异构体
4:稳定容易消旋的立体异构体
·氘代烷基化常用氘代烷基卤试剂







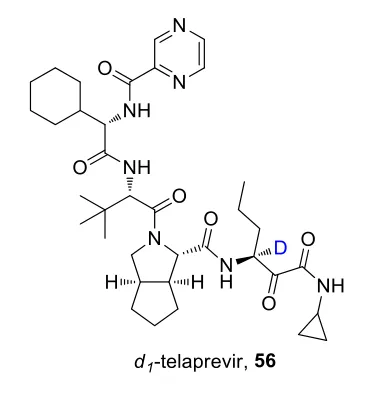
特拉匹韦的S构型处于羰基α位,在碱性条件容易消旋成R构型,导致活性降低30倍。使用氘取代氢后,提高了稳定性,减少了异构化率。
5:阐明药物作用机理

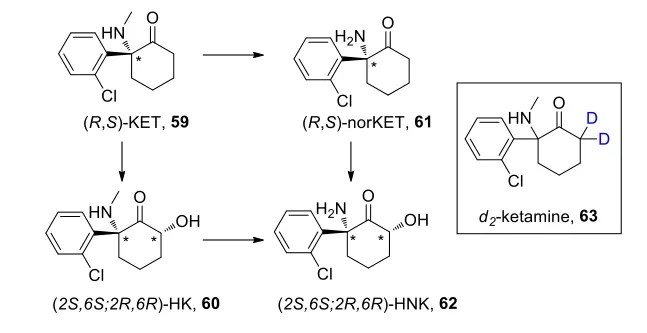
通过检测氯胺酮的代谢产物研究氯胺酮的抗抑郁机理。
合成的氘代氯胺酮不会影响大脑中的氯胺酮的浓度,但是会导致HNK水平减少,导致没有抗抑郁作用。最终确定62是产生抗抑郁作用的主要代谢物。
四、主要氘代合成工艺
一种是传统的多步化学合成,我们称之为“氘池”(deuterated pool Dp)合成;另一种是同位素交换法。
1:化学合成法通常使用含有氘的试剂进行化学反应,常用的试剂有氘气、氘代水、氘代碘甲烷、氘代甲醇、氘代乙醇、氘代苯、氘化锂铝等。
·氘代烷基化常用氘代烷基卤试剂

·氘代苯类

·还原氘试剂还原

·去官能化

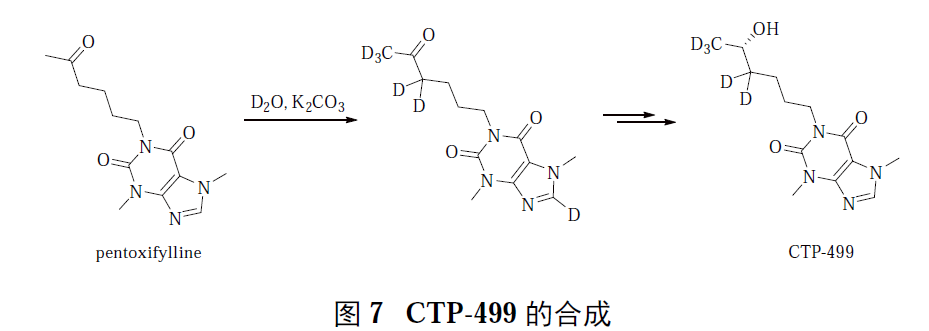
2:同位素交换法,一般可选用价廉的氘代水、氘代醇或氘代酸等。在交换过程中,需要加入过量的氘源,有时需要多次交换。
·酸碱催化交换

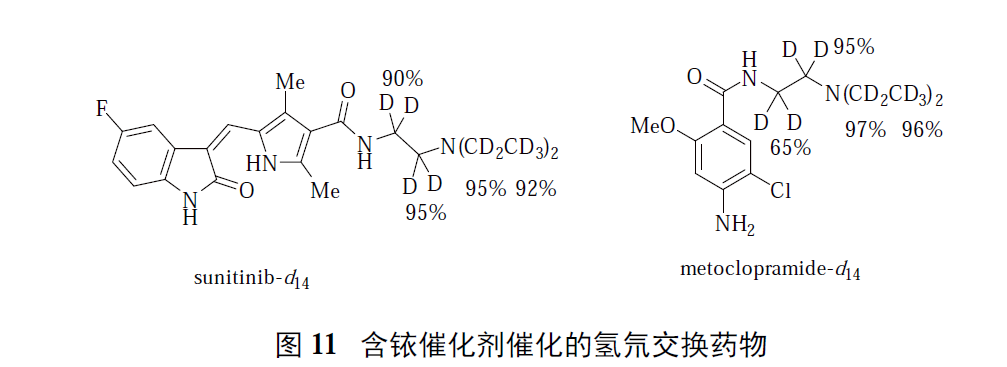
·金属催化交换


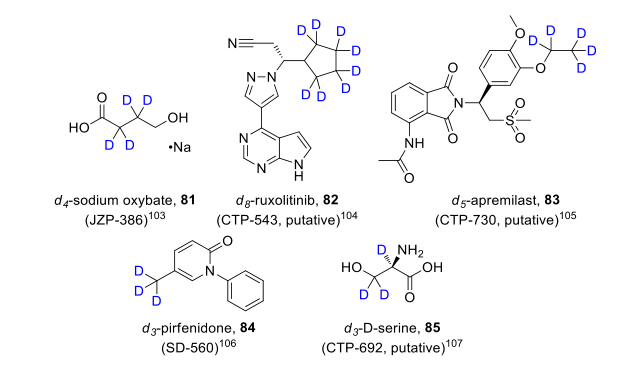
五、正在进行临床试验的氘代药物


不过氘代药物仍旧存在一些问题:
1:不能清楚认识到氘代的毒理数据
2:知识产权的风险
3:成本的不确定性等


